인간 생체 시계, 텔로미어
각종 질병과 연관성 발견돼
불로불사의 자연생물
자연환경에는 해파리나 바닷가재와 같이 노화를 겪지 않는 생물들이 존재한다. 홍해파리는 수명이 다하면 번데기 같은 모양으로 변해 그 안에서 다시 세포가 형성된다. 그리고 48시간 이내에 어린 모습으로 되돌아가서 다시 성장한다. 바닷가재의 경우 탈피를 하며 성장하는데 나이를 먹을수록 힘이 세지고 가임능력도 좋아진다. 다만 몸집이 커짐에 따라 껍질도 무겁고 단단해져 탈피가 어려워 진다. 결국 자연사하거나 탈피를 포기해 오염된 껍질 때문에 질병으로 사망한다. 이 경우를 제외한다면 바닷가재는 자연사하지는 않는다. 즉 환경의 조건이 어긋나거나 특별한 해를 가하지 않는 이상 그들은 죽지 않는다. 반면 인간은 노화를 겪기에 각종 질병에 걸리고 결국 자연사한다.
노화는 거스를 수 있는 것인가
MIT보다 앞서 텔로머레이스 유전자 확인에 성공한 빌 앤드루스는 『텔로미어의 과학』에서 “수명을 연장하기 위해서는 노화를 막아야 한다”고 설명했다. 노화를 막는 방법을 다루기에 앞서 노화를 왜 겪는지, 노화가 어떻게 진행되는 것인지에 대한 논의가 필요하다. 노화의 원인을 설명하는 관점들은 여러 가지 존재한다. 과학계에서는 그중 진화적 관점이 가장 인정을 받고 있다. 생물학적으로 생명체는 유전정보를 보존하기 위한 자손 번식을 주된 목적으로 한다. “진화적 관점에서는 이 목적을 위해 노화가 필요하다”는 것이 앤드루스의 주장이다. 예를 들어 사자는 불멸하는 반면 사슴은 노화를 겪는다는 생태계를 가정하면, 사슴은 세대교체를 겪으며 사자로부터 달아나기 위해 점차 달리기 속도가 빨라지거나 뿔이 자라는 등의 형태로 진화를 할 것이다. 반면 죽지 않는 사자는 진화하지 못해 사슴을 사냥하기 점점 어려워져 결국 멸종할 것이다. 이같이 생존 경쟁에 필요한 수단으로서 노화가 존재한다는 것이 진화적 관점의 입장이다. 앤드루스는 이에 대해 “인간의 경우 더 이상 생존 경쟁을 할 필요가 없기에 노화는 본질적으로 필요하지 않다”고 말한다.
노화를 막는 방법을 찾으려면 그 과정을 이해해야 한다. 노화는 텔로미어의 길이가 단축됨에 따라 세포가 노화하고 그와 함께 신체의 기능이 쇠약해지는 현상이다. 여기서 ‘텔로미어’는 DNA의 양 끝에 있는 특수한 부분을 가리킨다. 세포는 개체 유지를 위해 분열을 하는데 그 과정에서 유전정보를 담고 있는 DNA도 같이 복제한다. 여기서 복제 원리로 인해 끝부분에 유전정보의 소실이 생기는 ‘말단 복제 문제’가 발생한다. 이 문제를 방지하고자 DNA의 끝부분에 완충작용 역할로 텔로미어가 존재한다. 앤드루스는 “텔로미어는 세포분열을 반복함에 따라 길이가 조금씩 짧아지며 이것이 노화의 핵심 원인”이라고 설명한다. 만약 텔로미어의 길이가 일정 이상 짧아지게 되면 세포는 제 기능을 하지 못하게 된다.
시간을 되돌리다, 텔로머레이스
앤드루스는 “노화를 막는 방법은 본질적으로 텔로미어 길이를 늘리는 것”이라고 설명했다. 이는 생식 세포에서 아이디어를 얻을 수 있다. 정자와 난자 세포가 분열할 때, 텔로미어 길이를 유지해줄 장치를 필요로 한다. 그렇지 않다면 부모의 생식세포 속 짧아진 텔로미어가 그대로 자식에게 전달되면서 자식의 신체 나이가 부모와 같아지게 되기 때문이다. 실제로 생식세포는 텔로미어의 길이가 줄지 않는다. 연구를 통해 그 이유가 ‘텔로머레이스’라는 효소가 생성되기 때문임을 밝혀졌다. 앤드루스는 “텔로머레이스는 노화된 피부나 장기 등을 회복시키며 이미 모든 세포 내에 관련 DNA가 존재하기 때문에 따로 섭취하거나 직접 삽입할 필요가 없다. 오히려 삽입의 경우 무작위로 세포에 주입되므로 세포사나 암, 돌연변이 등이 발생할 가능성이 생긴다”고 주장했다. 다만 텔로머레이스 생성 유전자가 존재함에도 효소를 만들지 못하는 것은 유전자가 억제돼 있기 때문이다. 현재 해당 유전자를 발현하는 물질은 발견됐지만 노화를 완전히 억제할 정도의 완벽한 수준까지는 도달하지 못했다. 한편 텔로머레이스를 이용했을 때 생기는 부작용에 대해 우려의 목소리도 나온다. 과도한 텔로머레이스로 인해 개체가 유년 시절로 돌아가지는 않을까 하는 걱정이다. 앤드루스는 이에 대해 “노화와 발달의 차이를 혼동한 것이다. 발달은 자궁에서 수정된 시점부터 시작되지만 노화는 텔로머레이스 발현이 억제되는 순간부터 시작된다”고 설명했다. 즉, 완전한 텔로머레이스의 발현에 따른 결과는 건강한 20대로 회귀라는 것이 그의 주장이다.
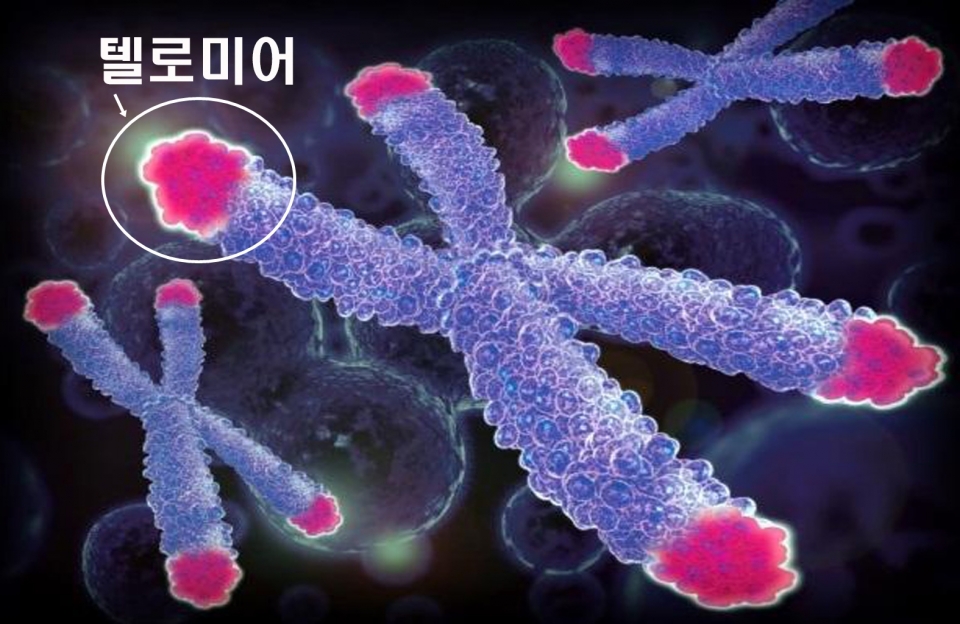
ⓒ느리게가는세상 블로그 제공

ⓒ느리게가는세상 블로그 제공
노화, 질병의 필요조건?
텔로머레이스는 암과도 연관이 깊다. 암세포는 무한정 분열하는 세포로 분열 주기의 이상이 생겨 주변 세포까지 다 잡아먹으며 자생한다. 무한정 분열이 가능하게 하는 것으로 앤드루스는 암세포 스스로 텔로미어 길이를 조절하는 장치를 제시한다. 실제로 연구를 통해 암세포는 텔로머레이스를 포함하고 있음이 발견됐다. 이에 대해 우리 학교 주경민(의학) 교수는 “암세포는 텔로미어가 짧아지는 것을 막기 위해 텔로머레이스를 발현하는데, 텔로머레이스가 많아지게 하는 유전자의 돌연변이가 발견됐다”고 설명했다. 한편 노화 억제를 위해 텔로머레이스를 활용하는 것은 암을 유발할지도 모른다는 걱정의 시선이 존재한다. 이에 대해 앤드루스는 “대다수 암세포가 텔로머레이스를 활성화하지만 텔로머레이스는 암세포의 원인이 아니다. 텔로머레이스 부족으로 인한 텔로미어 길이 단축이 염색체 재배열과 돌연변이를 유발한다는 연구가 상당수 발표됐다”고 주장했다. 나아가 텔로머레이스 활성화가 노화와 암 모두를 치유할 가능성을 다룬 연구가 보고됐다. 인체는 약 40조 개의 세포로 구성돼, 분열하는 과정에서 암세포와 같은 변이가 발생할 확률이 매우 높다. 이때 암을 파괴하는 데 능숙한 면역계를 통해 질병에 걸리지 않을 수 있는 것이다. 그러나 노화로 인해 면역계의 기능 수행에 문제가 발생하고 암에 걸리게 된다. 앤드루스는 “텔로머레이스는 노화로 짧아진 면역계의 텔로미어를 늘려줘 암을 예방할 수 있게 한다”고 설명한다.
노화 억제는 다른 질병과도 관련이 깊다. 앤드루스는 대표적인 예로 “알츠하이머는 신체적·정신적 퇴화와 가장 밀접한 관련이 있는 질병 중 하나”라고 설명한다. 연구를 통해 알츠하이머 환자는 뇌의 특정 세포에서 텔로미어 길이가 단축된 것으로 밝혀졌으며, 하버드 의과대학 데피노 박사 연구팀이 텔로미어 길이에 따라 뇌의 중량과 크기가 비례함을 보고했다. 이는 알츠하이머가 노화와 밀접한 관련이 있음을 뜻한다. 그 외에도 앤드루스는 “에이즈의 경우는 면역세포의 노화를 가속화시킨다는 점에서 관련이 있다”고 설명했다. 한 연구에 의하면 에이즈를 일으키는 HIV 바이러스의 유무에 따라 일란성 쌍둥이의 텔로미어 길이의 차이를 보였다.
노화 억제에 회의적인 시선들
앞서 보고됐던 수많은 연구 결과에도 불구하고 여전히 학계에서는 실효성에 대한 의문을 제기하는 이들도 존재한다. 주 교수는 “현재 유전자 치료는 실효성이 그리 크지 못하며 발현을 생체에서 적절히 통제하지 못하는 상태”라고 설명한다. 노화에 대해 치료의 실효성은 미비하며 추가적인 연구가 필요하다는 뜻이다. 한편 암 자체가 면역계를 억제하는 인자를 제시하기도 하는데, 최근 이러한 인자들을 억제해 면역계를 활성화하는 항암 면역치료가 효과를 보지 못했다. 이에 대한 해석으로 주 교수는 “아직 면역 억제 매커니즘이 완벽히 밝혀지지 않았으며, 텔로머레이스만으로 면역계가 회춘하는 것은 실현 가능성이 적을 것”이라며 “노화 기전에 대한 연구가 가장 필요하다”고 덧붙였다.

